【导读】
近日,杭州电子科技大学徐铭恩教授团队的魏小云副教授、黄贝思等在Materials & Design发表文章Dot extrusion bioprinting of spatially controlled heterogenous tumor models,开发了3D打印水凝胶微珠新技术(Dot-extrusion printing,DEP),该技术能够稳定、快捷、精准打印甲基丙烯酸酰化明胶(GelMa)水凝胶珠(GHBs);组合双喷头协同工作,可打印不同细胞组分的水凝胶微珠,灵活构建三维异质肿瘤组织模型。相比连续挤出微丝打印,凝胶微珠打印技术在高通量构建肿瘤组织/肿瘤类器官阵列、异质肿瘤模型等领域具有特殊优势,与Regenovo Bio-architect生物3D打印系统的融合,将为抗肿瘤新药开发、临床药敏试验提供新的高通量技术平台。

文章简介
在组织工程领域中,生物打印载细胞的水凝胶结构体,可提供三维空间架构和仿生体内的细胞外基质微环境,在构建功能性组织结构方面展现出巨大的潜力。而对于异质组织来说,迫切需要一种灵活、高效沉积多组分细胞的打印方法。微液滴打印主要生成离散的墨水液滴单元,利用液滴单元形成三维结构体,在构建异质组织结构应用上具有较大的灵活性,但所生成的液滴容易发生延展、融合等问题。微挤出式打印通过对生物墨水进行纤维丝成形,进而形成特定三维结构,适合打印多种水凝胶材料,但连续挤出的打印模式导致该技术在构建多组分异质结构方面缺乏灵活性。基于此,团队开发了一种微挤出点胶打印技术DEP,与传统微滴打印不同,DEP技术可直接在基底形成半凝胶态的微珠,避免了液滴飞溅、延展的情况,且无需在打印过程中对微滴单元进行实时固化。通过组合双喷头协同打印,并对GHBs的空间位置进行灵活调控,团队人员构建出空间异质性的肿瘤-基质模型,研究不同微环境中复杂的肿瘤基质相互作用(图1)。
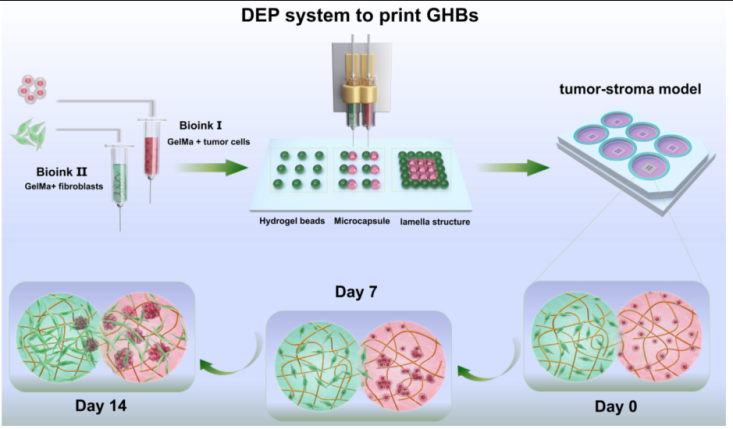
图1. DEP技术示意图
1)GHBs打印优化
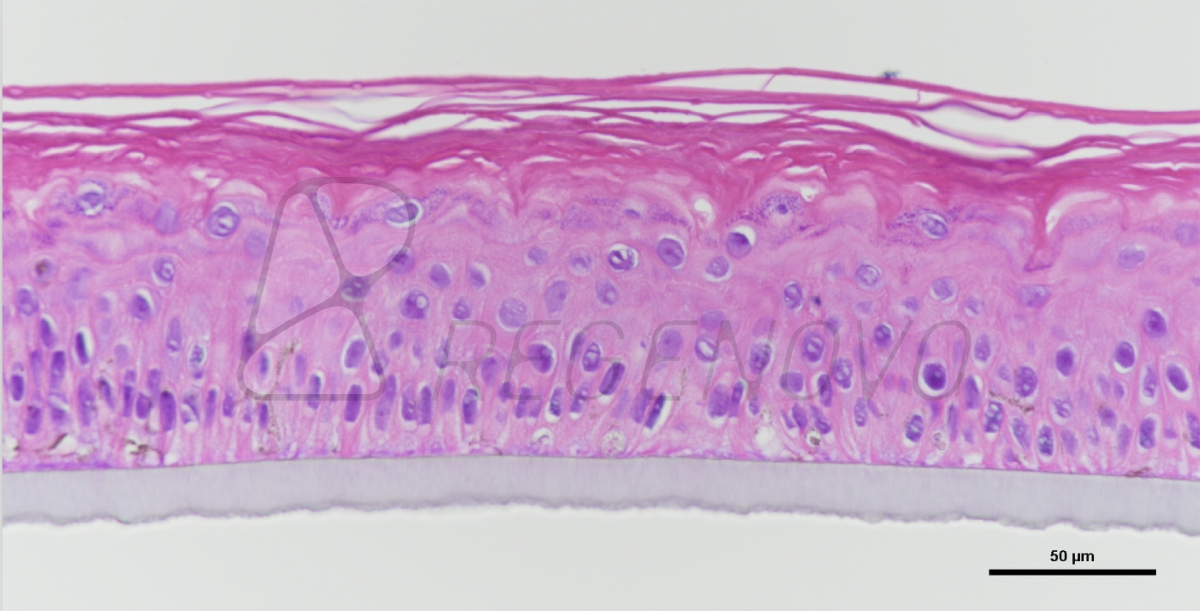
DEP技术主要采用气动式微挤出喷头在间歇式气压驱动打印模式下产生离散水凝胶微珠单元。具体为,通过G-code控制气压大小、给气频率、出料时间等参数,间歇式挤出水凝胶,进一步调控水凝胶的控温状态、与底板的接触作用形成形态均一的微珠结构。对于给定的驱动气压,可以通过调节水凝胶的挤出时间轻松获得不同粒径的GHBs。如下图所示,在不同挤出时间(500、800和1000 ms)下打印了不同浓度(5%、8%和10%)的GHBs,GHBs直径随挤出时间变化如图2C所示。打印过程中通过喷头控温促使GelMa液态-固态转变,需找到合适的温控区间以保证水凝胶处于半凝胶状态(semi-gelled),以保证挤出丝滑;温度过高或过低都不利于微珠的稳定打印。5、8、10%浓度GelMa合适的控温区间分别为10-12、14-16和18-20℃,与流变测试结果一致(图2E,F)
。
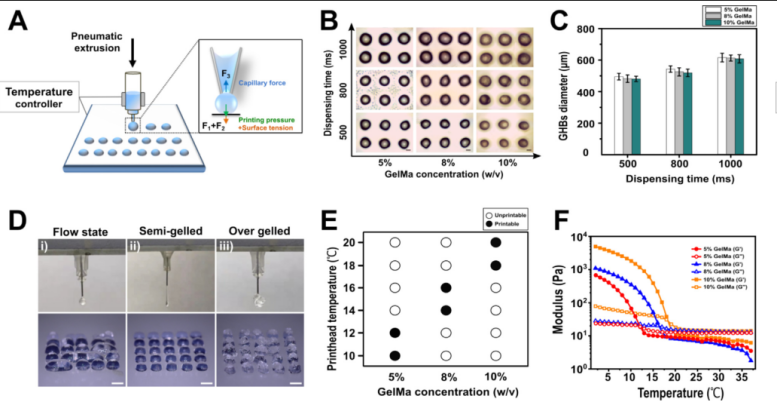
图2 . DEP技术产生GHBs
2)灵活打印GHBs构建3D结构
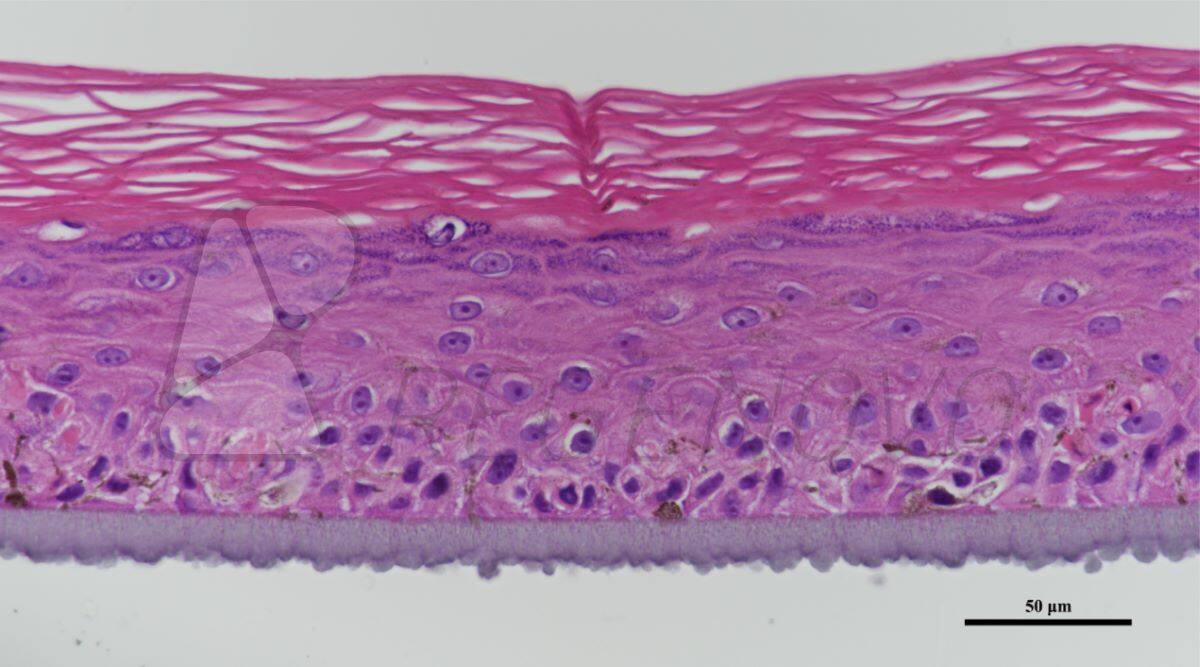
通过调控水凝胶微珠的间距(凝胶微珠圆心距),可控制两颗水凝胶微珠之间的空间位态,如相邻或相交,在此基础上可按照点成线、线成面的路线构建不同的三维结构体。例如,明确打印条件气压100 kPa、挤出时间1000 ms时,可产生的微珠尺度约为600 μm,通过设置圆心距分别为1000、800和600 μm,即可促使产生的水凝胶微珠具有不同的空间位态(如下图)。通过调整GHBs间距逐个打印GHBs以实现线结构,并进一步形成层状结构和多层管腔结构(图3C,D)。所构建的三维结构体在光固化后,可成功进行转移,验证了打印结构的稳定性(图3E)。

图3. 三维结构体构建
3)细胞打印和多球体肿瘤微珠制备
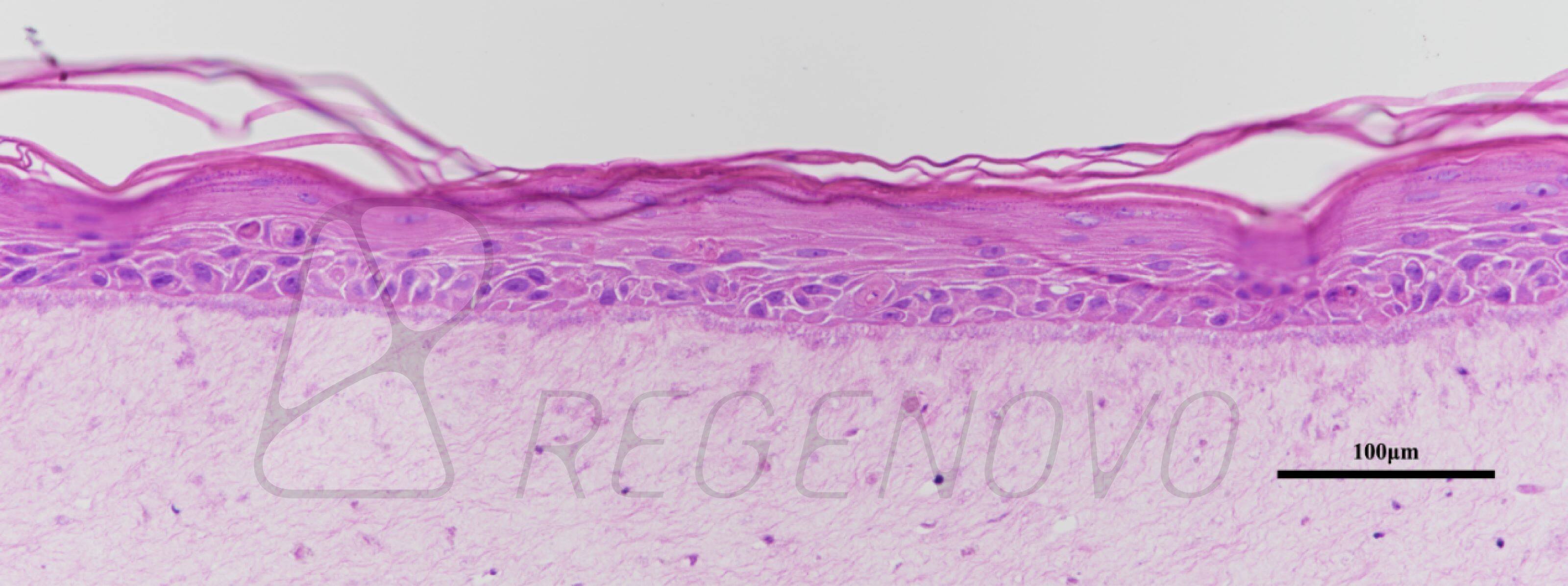
为了验证DEP技术的生物相容性,研究人员打印了包裹不同细胞密度的肿瘤细胞和正常成纤维细胞的GHBs,并进行细胞活性检测,结果显示打印后细胞存活率超过95%。进一步评估DEP技术对细胞行为的长期影响,研究人员打印了载不同细胞密度的肿瘤细胞(MCF-7)的GHBs,并培养了两周。结果显示,肿瘤细胞在GHBs内呈现出良好的增殖活力,形成了肿瘤小球(图4)。值得注意的是,GelMa凝胶微珠在整个培养阶段保持着较好的三维结构形貌,没有塌陷、变形的现象,为细胞球的三维生长提供了稳定的支撑环境。
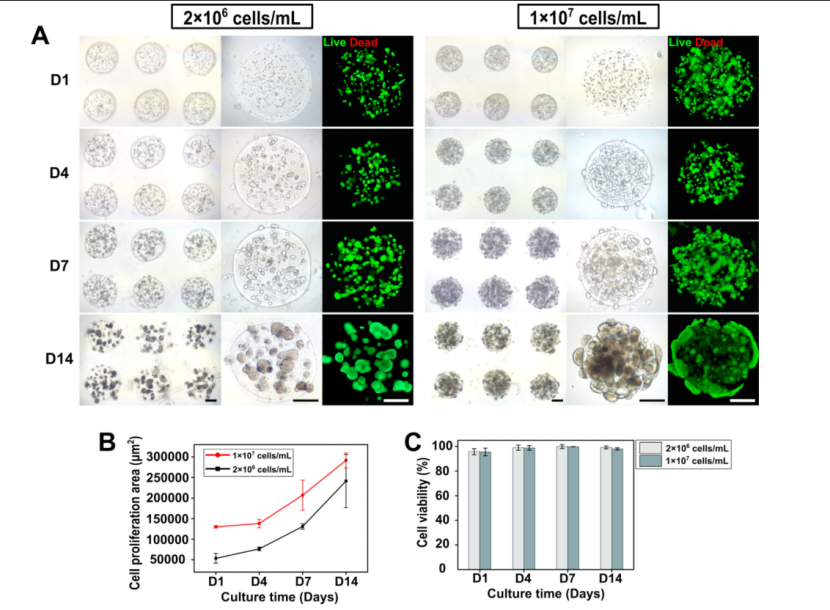
图4. 细胞打印和肿瘤微珠制备
4)异质结构体打印与肿瘤-基质模型构建
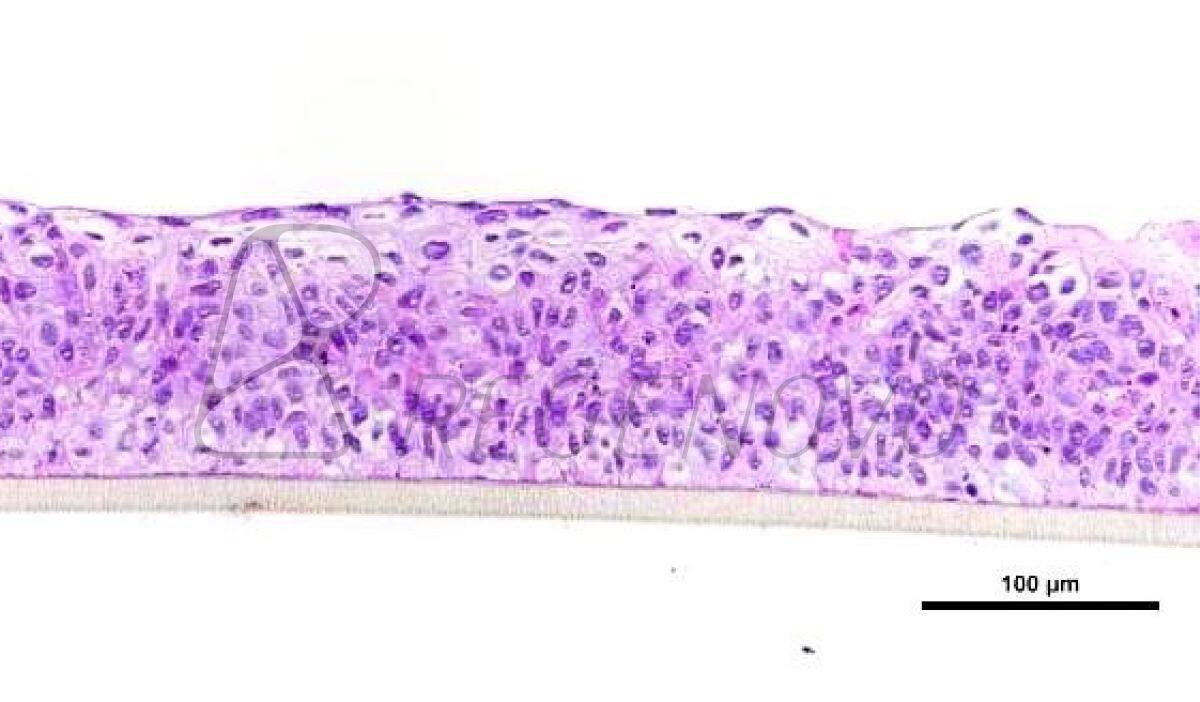
进一步,研究人员验证了DEP技术打印异质结构体的能力。对DiI标记的肿瘤细胞和DiO标记的正常成纤维细胞进行双喷头协同打印,可构建异质性GHBs胶囊结构、纤维结构和大尺度立方体结构(图5A,B,C)。基于此,研究人员将肿瘤细胞和正常成纤维细胞进行空间区域性沉积,构建出重叠(直接接触)和并列(非直接接触)的微胶囊结构进行共培养,以研究肿瘤和基质的直接作用和旁分泌作用。对照组为单培养肿瘤细胞和正常成纤维细胞(图5D)。在培养过程中,两种共培养模型中的肿瘤球体都显示了向成纤维细胞侧侵袭的现象,采用典型肿瘤相关成纤维细胞(CAFs)标志物FAP对不同空间模式下的成纤维细胞进行蛋白鉴定。结果证实相比单培养模型,两种共培养模型中的成纤维细胞均显示出较强的FAP表达(图6A,B),这表明肿瘤通过旁分泌和直接接触方式活化了正常成纤维细胞,使其获得了CAFs表型。

图5. 空间异质性肿瘤模型构建
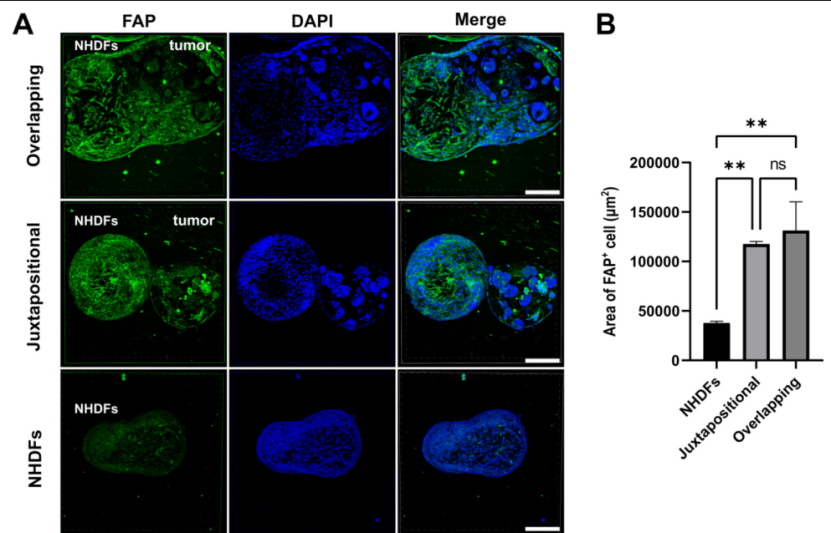
图6. 不同异质模型的FAP表达水平
结论
综上所述,本研究开发了一种水凝胶微珠打印技术(DEP),并验证了其构建空间异质性肿瘤模型的能力。采用单喷头打印负载肿瘤细胞的GHBs阵列,可形成活性优良的肿瘤微珠结构体,在高通量药物筛选应用上具有较大的潜力。组合双喷头协同打印,可灵活调控不同细胞组分的空间位置,构建不同空间架构的肿瘤组织结构体,在研究肿瘤侵袭、转移等方面优势明显。在后续研究中,将DEP技术与其他生物材料如海藻酸盐、胶原和基质胶结合,制备肿瘤特异性基质模型将有望推动肿瘤研究进程。