【导读】
糖尿病的患病率在世界范围内呈增长趋势,而糖尿病足溃疡(DFU)难以愈合,最终可能导致患者截肢。自体皮肤移植或刺激创面边缘皮肤细胞使其增殖并闭合创面是治疗DFU最有希望的方法之一。
最近,加拿大Laval大学的Atieh Abedin-Do等人在Frontiers in Bioengineering and Biotechnology上发表了题为《Engineering diabetic human skin equivalent for in vitro and in vivo applications》的论文。研究人员设计了一种含有从糖尿病患者皮肤中提取的成纤维细胞和角质形成细胞的皮肤等价物(DHSE)。将DHSE用于研究低强度电刺激(ES)是否能提升糖尿病细胞活性。实验结果证明,从老年糖尿病患者皮肤中提取的成纤维细胞和角质形成细胞可以用于DHSE工程。此外,DHSE暴露于ES中会导致组织分层、Ki-67表达增加和基底膜蛋白(层粘连蛋白和IV型胶原蛋白)沉积的结构改善,增加了角质细胞的增殖。研究表明DHSE可能是各种体外研究的一个有前途的工具,以了解慢性炎症条件下的伤口愈合机制,如糖尿病,并且证明了ES可以促进糖尿病伤口愈合。
皮肤组织采集自年龄在70至80岁之间的因糖尿病足溃疡而截肢的患者。皮肤组织切成小块,并在37°C下用热溶酶(500 ug/ml)处理24小时,以分离表皮。采集表皮样本采集表皮样本,用0.05%的胰蛋白酶-0.04乙二胺四乙酸溶液培养45分钟。搅拌下45分钟,以提取糖尿病人皮肤角质细胞(DHSK)。皮层样品用0.125 U/ml的胶原酶-P(Boehringer Mannheim)消化60分钟,以提取糖尿病人皮肤成纤维细胞(DHSF)。成纤维细胞在含有10%胎牛血清、100 U/ml青霉素G、25 μg/ml链霉素和0-5 μg/ml真菌素的Dulbecco改良Eagle培养基(DMEM)中培养。角质细胞在DMEM-Ham's F12(DMEMH)中培养。角质细胞培养基还补充了10 ng/ml的EGF,0.4 μg/ml的氢化可的松,5 μg/ml的转铁蛋白,5 μg/ml的胰岛素,100 U/ml的青霉素,25 μg/ml的链霉素,和0-5 μg/ml的真菌素。成纤维细胞和角质细胞在含有5%二氧化碳的湿润环境中于37℃下培养。然后对细胞进行传代培养,角质细胞在2期时使用,成纤维细胞在3期时使用。
将成纤维细胞(1×106个细胞)与I型牛胶原蛋白溶液(Cat.No.5005-100ML, Advanced BioMatrix, Carlsbad, US)混合,其中含有29.5%的DMEM(Dulbecco's Modified Eagle Medium)2.7 x,20%的血清和0.05%的NaOH 0.2N。将该混合物倒入含有锚定物的12孔组织培养板的孔中,以防止工程真皮的收缩。然后将孔板转移到培养箱中,在37°C下培养2小时,以帮助胶原蛋白凝胶聚合。在这个培养期结束时,向每个孔中加入3毫升DMEM,并在含有5%二氧化碳的潮湿环境中于37°C培养4天,以形成真皮等效物,培养基每天都换液。将汇合度为80%的角质细胞从培养瓶中分离出来,进行计数,并在每个真皮等效物的顶部播种(9 × 104/cm2)。这些DHSE在浸泡条件下生长6天,以达到角质细胞汇合的程度。通过将DHSE提高到气-液界面再培养4天,获得表皮分层。
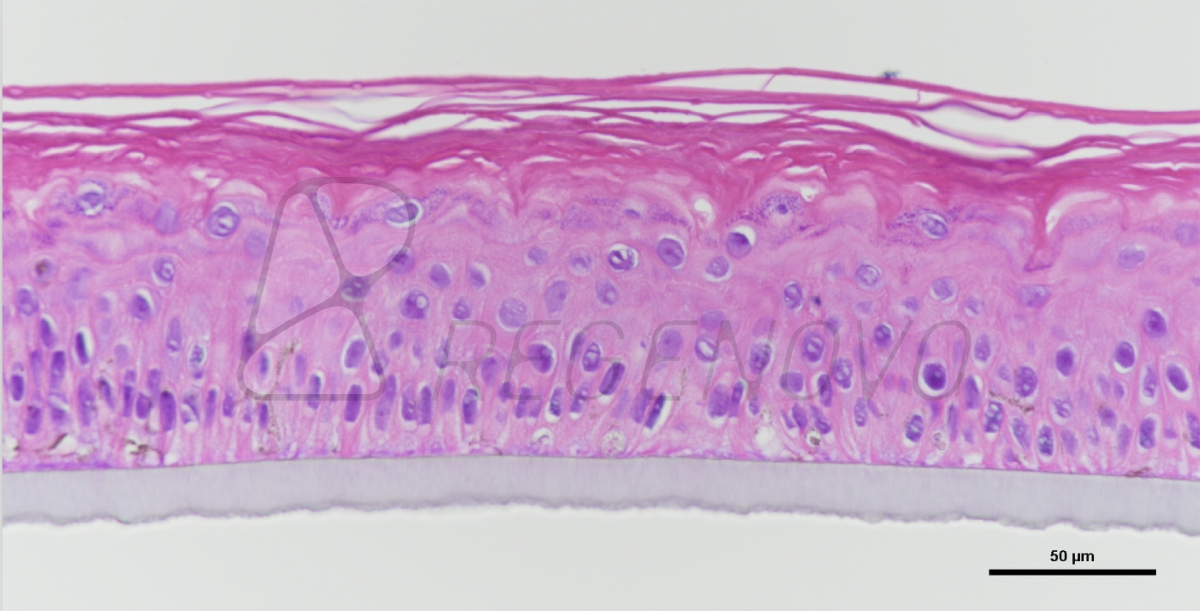
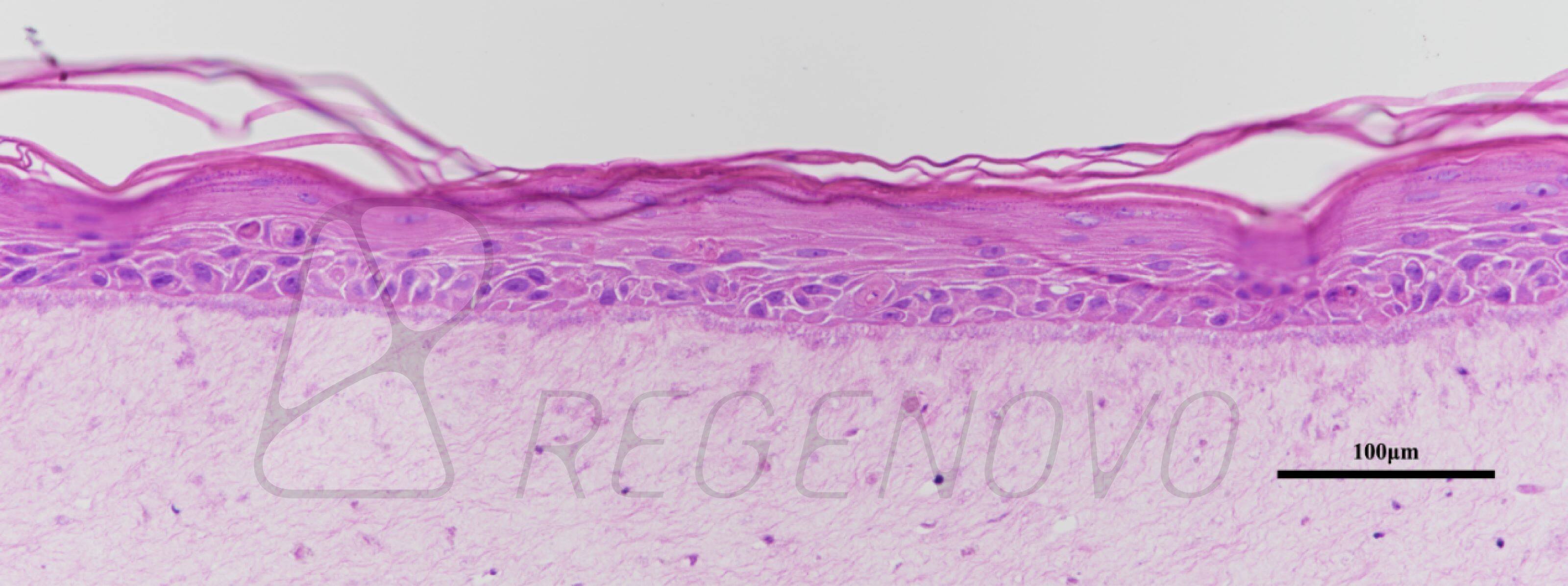
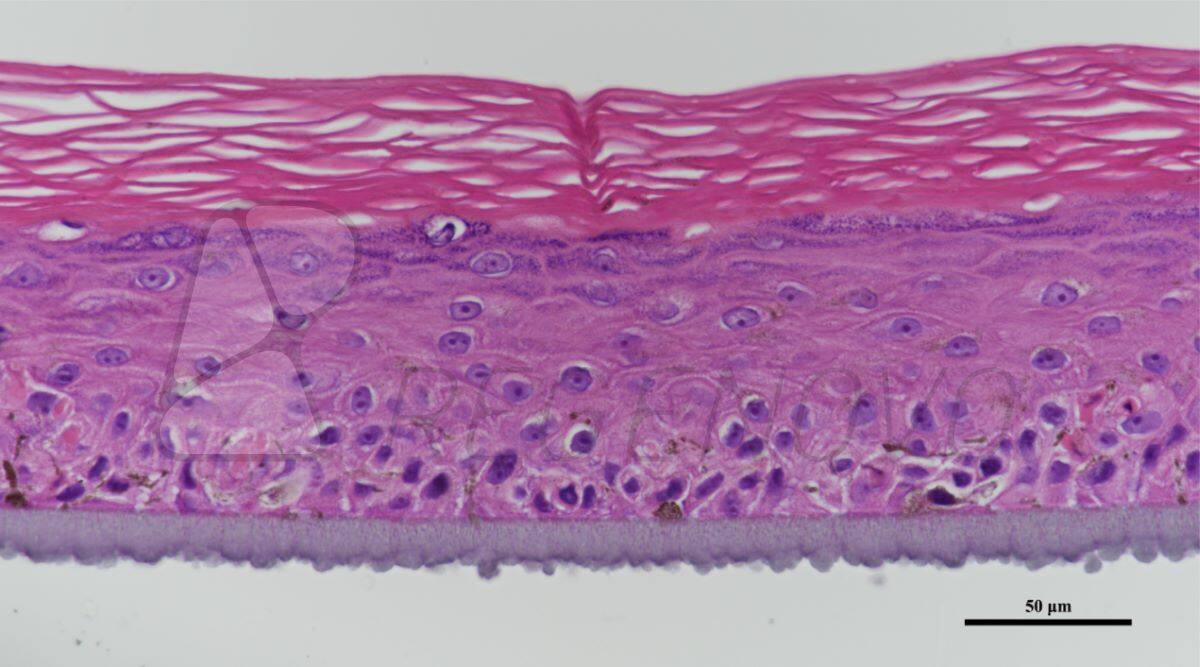
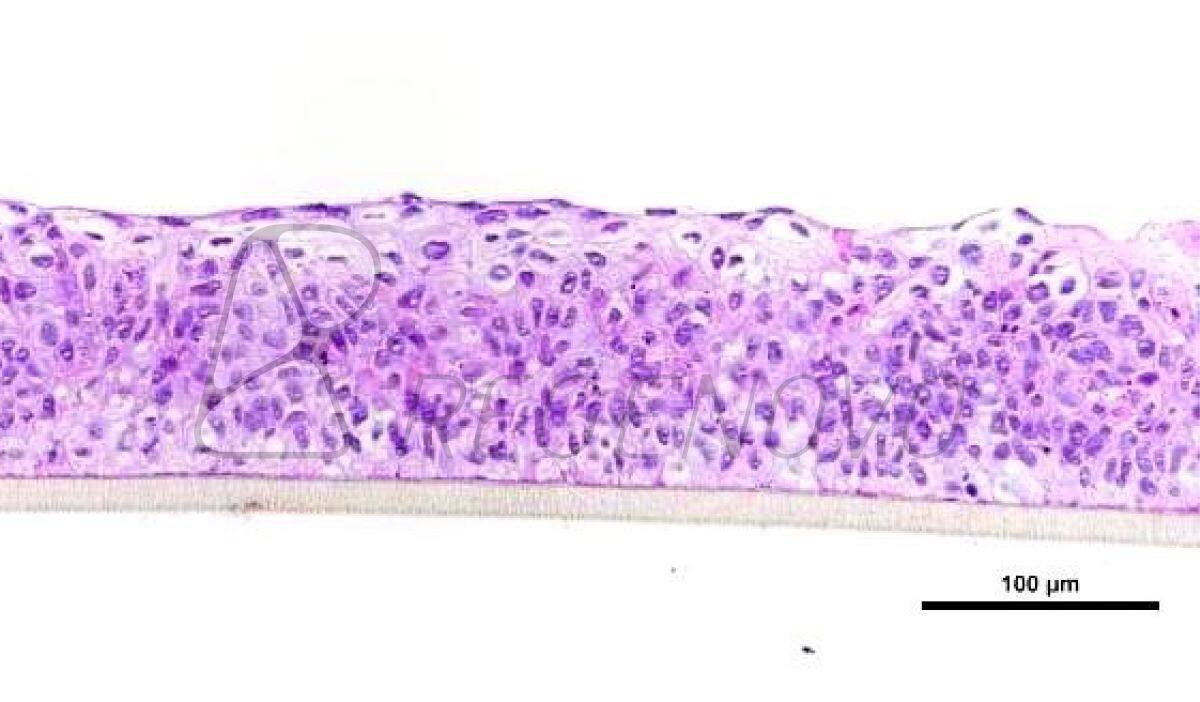
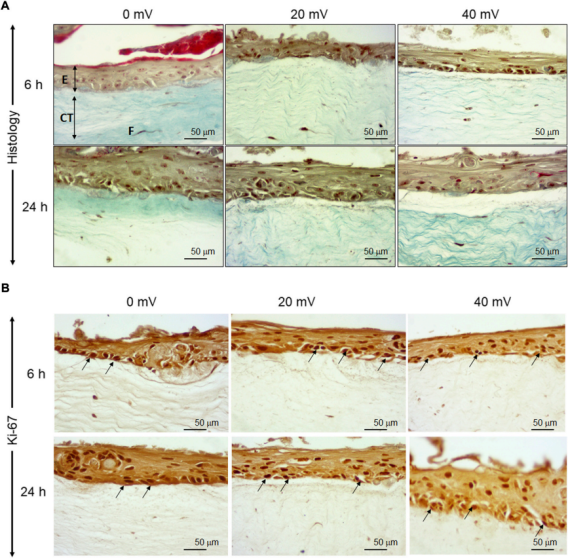
图1. 糖尿病皮肤组织结构的等效物。使用从糖尿病供者的皮肤中提取的成纤维细胞和角质形成细胞生成皮肤等效物。生成的皮肤等效物暴露于或不暴露于20或40 mV/mm的电刺激下。在暴露于ES后,立即对组织进行结构分析。图A显示了Masson三色染色的组织。图B显示了ki-67染色的细胞。(E)、表皮;(CT)、结缔组织;(F)、成纤维细胞。
角质细胞和成纤维细胞在DHSE中合作合成了真皮-表皮蛋白。在基因表达水平上,在20 mV/mm下暴露6小时,层粘连蛋白的表达下降,但在40 mV/mm下暴露同一时期,层粘连蛋白的表达增加。而对于24小时的暴露,层粘连蛋白基因的表达在20和40 mV/mm时下降。
IV型胶原蛋白的基因表达在24小时暴露于20或40 mV/mm后增加,对于6小时的暴露,只有40 mV/mm的强度导致IV型胶原蛋白基因表达的显著增加(P < 0.001)。
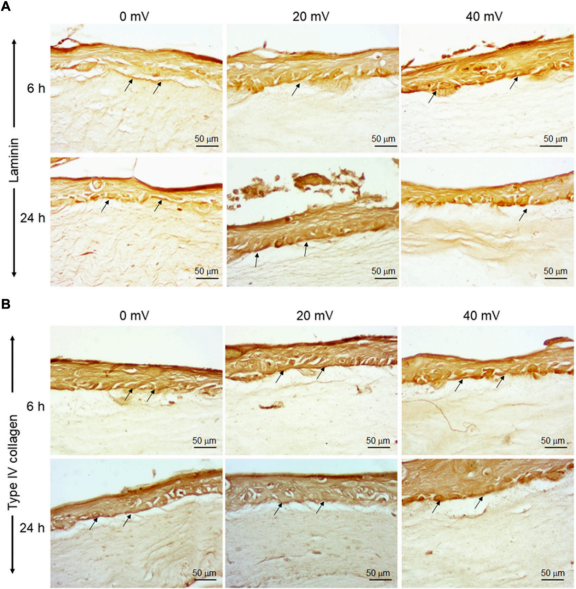
这些基因表达的结果得到了层粘连蛋白和IV型胶原蛋白的免疫组织化学染色的支持。如图2A所示,无暴露和ES暴露的组织都分泌了层粘连蛋白(箭头)。对于IV型胶原蛋白也得到了类似的结果。图2B显示(箭头)IV型胶原蛋白沉积在表皮和真皮之间和真皮之间。
图2. 层粘连蛋白和IV型胶原蛋白在DHSE基底层的沉积。在组织工程和暴露于ES 6和24小时后,通过免疫组织化学评估层粘连蛋白和IV型胶原蛋白的存在。图A显示层粘连的组织。图B显示IV型胶原蛋白染色的组织。箭头指出了被染色的蛋白质(n = 4)。
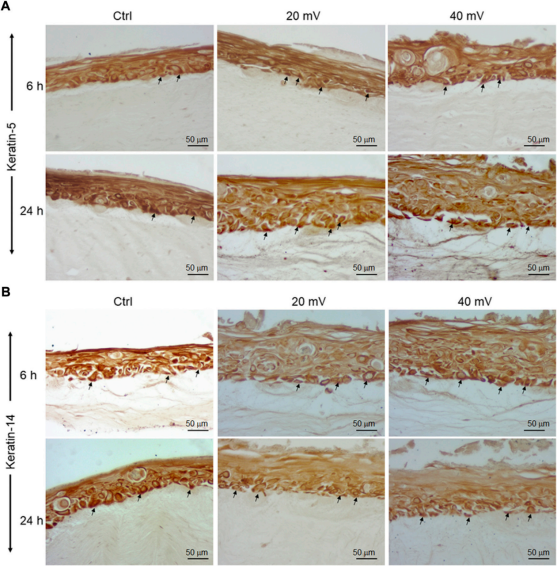
增生的角质细胞在基底层和上基底层表达不同类型的蛋白质。在这项研究中。分析了K5和K14基因的表达。结果表明,基因表达量有所增加。暴露在ES中6小时,导致K14在20和40 mV/mm时的表达量显著增加。暴露在ES中24小时,20和40 mV/mm时都有显著增加。蛋白质的分析支持了基因表达的分析。如图3所示,免疫组化染色后有几个K5和14阳性细胞。图3A显示基底层和上基底层的K5阳性细胞(箭头)。与未暴露于ES的组织相比,K5阳性细胞的密度相似,证实了基因表达的分析,类似的观察结果也适用于K14(图3B)。
图3. 接触或不接触ES后DHSE中的K5(A)和K14(B)阳性细胞。将DHSE暴露在20 mV/mm或40 mV/mm下6和24小时。组织切片分别用K5和K14的特异性抗体进行染色。照片是3个不同实验的代表,每个实验一式三份的条件下进行。箭头显示基底层和上基底层的染色细胞。
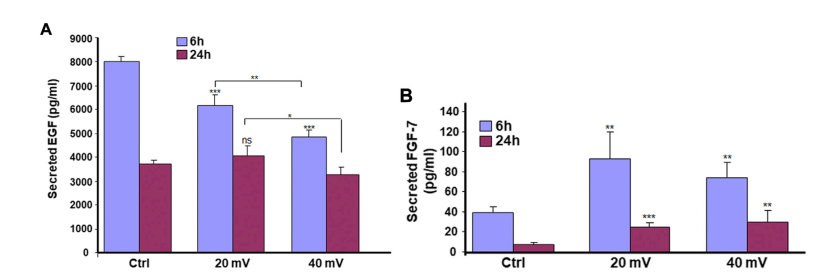
如图4A所示,对照组和试验组的EGF分泌量都随着时间的推移而减少。对照组在6小时时分泌量最高,但在24小时时所有三组的分泌量变得相似。此外,与20 mV/mm相比,在6小时内观察到的减少在40 mV/mm更明显。对FGF-7分泌的测量显示(图4B),在20 mV/mm和40 mV/mm下暴露6小时和24小时都有明显增加。
图4. ES调节糖尿病皮肤细胞的EGF(A)和FGF-7(B)的分泌。DHSE暴露在20或40mV/mm的ES下6和24小时,每个暴露期结束后,立即用培养基测量EGF和FGF-7的水平。结果表示为三个不同实验的一式三份测定的平均值±SD。(ns),不显著。*P˂ 0.05, **P˂ 0.01, ***P˂ 0.001。自由星号指的是ES暴露与未暴露组织比较时的统计学差异。带星号的条形图显示了ES不同强度的比较.
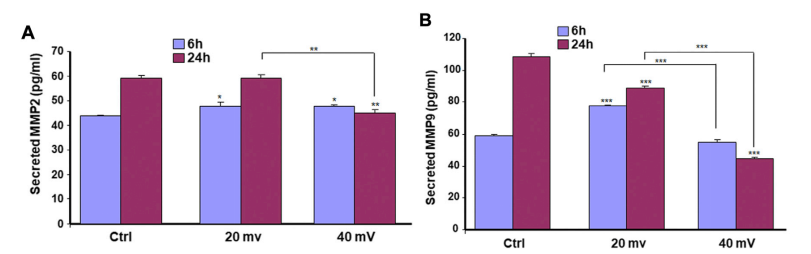
在接触ES 6h或24h后立即收集每个培养物的培养基,并进行ELISA检测以量化不同介质的分泌。DHSE中的细胞中的细胞可以产生MMP-2和MMP-9,并且达到可检测的水平。对照组和试验组都能产生MMP-2和MMP-9。对于MMP-2,该酶在暴露于20和40 mV/mm条件下6h后略有增加(图5A)。然而,在暴露于ES的24小时后,MMP-2 水平在20 mV/mm时没有变化,但在40 mV/mm时下降。对于MMP-9,两种ES强度(20 mV/mm和 40 mV/mm)都导致了显著的下降(P < 0.001),除了 6小时的ES在20 mV/mm时,MMP-9增加(p < 0.001)。
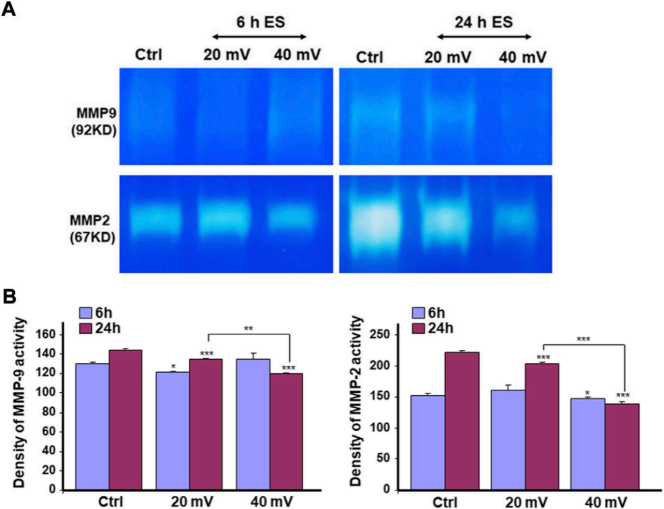
酶谱分析评估这些MMP-2和MMP-9酶的蛋白水解活性。如图6A所示,中度明胶降解带是指MMP-9的活性。暴露于ES 24h后,对照组的降解比暴露于ES的组织高。另一方面,24h ES明显降低了MMP-2对明胶的活性,因为对照组的裂解带比ES组的强。这意味着24小时暴露于ES导致了更高的MMP2活性抑制(图6A)。半定量分析证实了MMP-2和MMP-9对明胶活性的这种下降(图6B)。总的来说,工程DHSE中的细胞显示出MMP-2和MMP-9的活性,通过暴露在ES中而降低。
图5. ES调节糖尿病皮肤细胞的MMP2(A)和MMP9(B)的分泌。DHSE暴露于20或40 mV/mm的ES中6和24小时,每个暴露期结束后,立即用培养液测量MMP2和MMP9的水平。结果表示为三个不同实验的一式三份测定的平均值±SD。(ns),不显著。*P˂ 0.05, **P˂ 0.01, ***P˂ 0.001。自由星号指的是ES暴露与未暴露(Ctrl)组织比较时的统计学差异。带星号的条形图表示不同强度的ES的比较。
图6. ES降低了MMP2(A)和MMP9(B)的蛋白水解活性。DHSE暴露于20或40 mV/mm的ES中6和24小时。在每个暴露期结束后,立即用培养基来评估明胶消化的情况,使用酶谱分析。对三个实验的代表性凝胶进行拍照和展示。使用ImageJ分析进行定量测量。在ES暴露和未暴露的条件下,*P˂ 0.05,**P˂ 0.01。
结论
此研究证明了工程DHSE中的细胞产生了可检测到的MMP-2和MMP-9的数量并且这些酶的水平和活性在组织暴露于ES后都有所下降。这项工作本研究提出从糖尿病患者皮肤中提取和培养角质细胞和成纤维细胞的可能性,并且首次将这些细胞用于设计DHSE。发现ES通过细胞的增殖和基底膜蛋白的产生有效地改善了皮肤组织结构,还促进了FGF-7的分泌,但没有促进EGF的分泌。MMP-2和MMP-9的水平和活性都有所下降,MMP-2和MMP-9的减少表明细胞外基质(ECM)的加速积累,以促进组织的再生,表明ES可以通过降低蛋白酶的活性来减少所需ECM的降解来促进伤口愈合。总的来说,这些结果展现了DHSE的潜力,并且未来可能与ES结合,用于治疗和分析应用。
【原文信息】
A. Abedin-Do, Z. Zhang, Y. Douville, et al., “Engineering diabetic human skin equivalent for in vitro and in vivo applications,” Frontiers in Bioengineering and Biotechnology 10:989888 (2022)
糖尿病人皮肤等效物(DHSE)的制备
DHSE组织结构
如图1A所示,在对照组(0 mV/mm)中,表皮由几层细胞组成。在真皮层中,成纤维细胞与胶原纤维平行排列。在试验组中,将DHSE暴露在20 mV/mm和40 mV/mm的低强度电刺激环境中6和24小时,对组织结构没有宏观影响。表皮在真皮上形成几个结构良好的层。总的来说,这些结果证明了使用从糖尿病供体的人类皮肤中提取的成纤维细胞和角质细胞生成皮肤等效物的可行性。为了进一步确定工程DHSE的特征,进行了Ki-67染色作为增殖细胞的标志。图1B显示了对照组(0mV/mm)组织中大量的Ki-67阳性细胞,证实了糖尿病角质细胞的增殖能力。有趣的是,暴露于20和40 mV/mm的角质细胞显示出比对照组(未暴露的细胞)更高的Ki-67细胞密度。
DHSE基底层的基因表达
K5和K14基因表达
表皮生长因子(EGF)和成纤维细胞生长因子(FGF)的分泌
ELISA和明胶酶谱法分析